Конспекты | Биология и Химия
📚 Самый полезный канал по Биологии и Химии в Телеграме!
🪧 Реклама @biologads
Официальный Youtube канал https://www.youtube.com/@konspekty_ege
Наш официальный сайт konspektyege.blog
№ 4938926149
💬 Наш чат https://t.me/+RZcT1yFIWF02NTUy
Recent Posts
😰 До ЕГЭ по биологии ~100 дней, ты бесконечно решаешь тесты по биологии - но всё ещё не знаешь, сдашь или нет.
Знакомо это ощущение?
Вроде занимаешься, теорию учишь, пишешь конспекты - а в голове всё равно есть тревога «а вдруг не хватит баллов?»
Нет ответа на главный вопрос - на сколько ты можешь сдать экзамен прямо сейчас?
Мы нашли бота, который покажет тебе твой уровень подготовки.
Проходишь тест → получаешь прогноз балла ЕГЭ → видишь конкретно, какие темы тебе нужно подтянуть, он показывает точечно: изучи эти 3 темы, и балл вырастет.
Формат в боте легкий для восприятия, даже самые сложные темы сможет понять каждый. Первый урок доступен бесплатно.
Проходите тестирование, пока висит пост👇
→ https://t.me/bio_boss_bot?start=blogger16
Знакомо это ощущение?
Вроде занимаешься, теорию учишь, пишешь конспекты - а в голове всё равно есть тревога «а вдруг не хватит баллов?»
Нет ответа на главный вопрос - на сколько ты можешь сдать экзамен прямо сейчас?
Мы нашли бота, который покажет тебе твой уровень подготовки.
Проходишь тест → получаешь прогноз балла ЕГЭ → видишь конкретно, какие темы тебе нужно подтянуть, он показывает точечно: изучи эти 3 темы, и балл вырастет.
Формат в боте легкий для восприятия, даже самые сложные темы сможет понять каждый. Первый урок доступен бесплатно.
Проходите тестирование, пока висит пост👇
→ https://t.me/bio_boss_bot?start=blogger16
Сложные эфиры и жиры.
🤖 Наш бот с опросами, вопросы жирные и сложные. Уверен вы справитесь 😊
Падаю в светящийся океан 🐳
Венерина мухоловка (лат. Dionaea muscipula) — вид хищных растений из монотипного рода Дионея семейства Росянковые (Droseracea). Растение болотистых областей восточного побережья Соединённых Штатов Америки.
Венерина мухоловка ловит своих жертв (насекомых, паукообразных, бесхвостых земноводных) с помощью специализированного ловчего аппарата, образованного из краевых частей листьев. Захлопывание ловушки инициируется тонкими триггерными (чувствительными) волосками на поверхности листьев.
Для захлопывания ловчего аппарата необходимо оказать механическое воздействие минимум на два волоска на листе с интервалом не более 20 секунд. Такая избирательность обеспечивает защиту от случайного захлопывания в ответ на падение объектов, не имеющих питательной ценности (капли дождя, мусор и т.д.).
Более того, переваривание начинается как минимум после пятикратной стимуляции чувствительных волосков.
Прогресс и регресс.
🧠 Проверь свои знания по ЕГЭ, узнай есть прогресс или регресс.
Прогулка используется как: 🤩 способ улучшить память 😊 способ повысить концентрацию 😝 способ снизить стресс 💯 инструмент для креативности Выводы основаны на статьях из ScienceDirect, JAMA network, PubMed 🏆 Проверь свои знания по ЕГЭ Сразу после прогулки
Прогулка используется как:
🤩 способ улучшить память
😊 способ повысить концентрацию
😝 способ снизить стресс
💯 инструмент для креативности
Выводы основаны на статьях из ScienceDirect, JAMA network, PubMed
🏆 Проверь свои знания по ЕГЭ Сразу после прогулки
Выводы основаны на статьях из ScienceDirect, JAMA network, PubMed
Распознавание органических веществ
Вместо скролинга соцсетей решайте тесты☺️
🤖 Наш бот с опросами
Вместо скролинга соцсетей решайте тесты
Накидайте реакций под этим постом, нам будет очень приятно
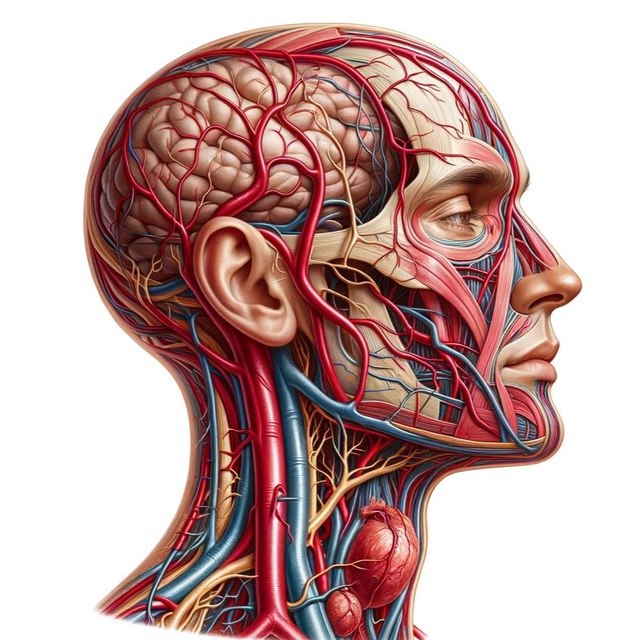
#шпаргалка#биология#анатомия
🩸Кроветворные органы, депо крови — органы, служащие местом образования форменных элементов крови.
🧪 К внутренней среде организма относятся кровь, лимфа, тканевая и спинномозговая жидкости.
🍀 Подписаться на канал
#анатомия#кровь
#анатомия#кровь
Носоглотка 🧑🔬
#анатомия#конспекты
#анатомия#конспекты




